U lympho Hodgkin được đặt theo tên Thomas Hodgkin, người đầu tiên mô tả một số bệnh lý ác tính của hệ bạch huyết vào năm 1832. Năm 2008, tổ chức y tế thế giới (WHO) chia HL thành 2 nhóm phân biệt: HL kinh điển được đặc trưng bởi sự hiện diện của tế bào u khổng lồ đa nhân có nguồn gốc tế bào B (tế bào Reed-Sternberg) và HL thể nốt trội lympho bào với tế bào L&H.

I. Bệnh học (Pathology)
– HL thể nốt trội tế bào lympho (Nodular lymphocyte predominant – NLPHL):
+ Chiếm tỷ lệ <5% HL.
+ Tỷ lệ nam giới mắc bệnh nhiều hơn nữ giới.
+ Giai đoạn I thường biểu hiện ở một vị trí hạch ngoại vi (cổ, nách hay bẹn), rất hiếm khi gặp hạch trung thất ở thời điểm khởi phát bệnh.
+ Đặc trưng bởi sự hiện diện của một biến thể của tế bào Reed-Sternberg, với tên gọi tế bào L & H hay tế bào “bắp rang” (popcorn cell), tế bào này bộc lộ các dấu ấn bề mặt của tế bào lympho B (CD20+), âm tính với CD15 và CD30.
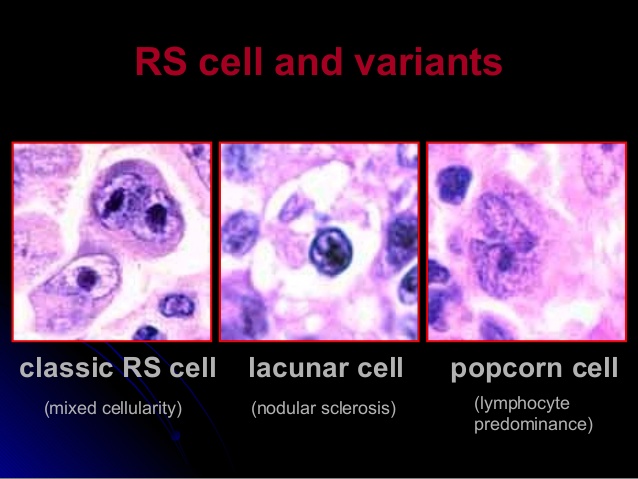
– HL kinh điển (Classical Hodgkin lymphoma):
+ Bao gồm các thể: giàu lympho bào (lymphocyte rich), xơ nốt (nodular sclerosis), hỗn hợp (mixed cellularity), và thể mất lympho bào (lymphocyte-depleted).
+ Tế bào ác tính đặc trưng là tế bào Reed-Sternberg (RS): CD30+, CD15+, CD45- và J-chain âm tính.
+ Những kháng nguyên protein liên quan đến EBV được tìm thấy trong khoảng 30-50% trường hợp (có thể cao hơn ở các nước đang phát triển, 70-80%).
+ CHL giàu lympho bào: không hay gặp (5% HL), thường biểu hiện với bệnh cảnh khu trú tại một vùng hạch ngoại vi.
+ Thể xơ nốt: dưới nhóm HL phổ biến nhất tại các nước phương Tây, 65-70% tại Mỹ. Đây là dưới nhóm duy nhất không thể hiện sự ưu thế của nam giới trong tỷ lệ mắc. Mô u có hình thái dạng nốt cùng với các dải collagen, tế bào u đặc trưng bởi tế bào khuyết (lacunar cell – biến thể của tế bào RS). Đa số được phát hiện ở giai đoạn sớm (I hoặc II) với biểu hiện tại hạch cổ và trung thất.
+ Thể hỗn hợp tế bào: thường gặp hơn ở các quốc gia đang phát triển, liên quan đến tình trạng nhiễm EBV. Tỷ lệ mắc tăng dần theo lứa tuổi, và tình trạng nhiễm HIV (ở các nước phương Tây). Người bệnh thường có các biểu hiện của hội chứng B ở giai đoạn muộn, với xu hướng thâm nhiễm lách và tuỷ xương, ít gặp biểu hiện tại trung thất.
+ Thể mất lympho bào: hiếm gặp, dễ nhầm lẫn với u lympho không Hodgkin, có tiên lượng xấu.
| Tiêu chuẩn định týp miễn dịch trong phân loại u lympho Hodgkin | ||
| Dấu ấn | NLPHL | HL kinh điển |
| CD45 | + | – |
| CD30 | – | + |
| CD15 | – | + |
| CD20 | + | -/+ |
| EMA | +/- | – |
| LCA | + | – |
| BCL-6 | + | – |
| Oct 2, BOB.I | + |
II. Xếp loại giai đoạn và tiên lượng
1. Hệ thống Ann Arbor:
UICC sử dụng hệ thống phân loại Ann Arbor cho u lympho Hodgkin.
| Giai đoạn | U lympho Hodgkin |
| I | Biểu hiện tại một vùng hạch Hoặc biểu hiện 1 ổ khu trú tại một cơ quan hay 1 vị trí ngoài hệ bạch huyết (*) (gan, phổi, tuỷ xương, xương) (IE) |
| II | Hai hoặc nhiều hơn hai vùng hạch, cùng phía (trên hoặc dưới) so với cơ hoành – Kèm theo tổn thương 1 ổ khu trú tại một cơ quan hay vị trí ngoài hệ bạch huyết VÀ hạch vùng tương ứng.(IIE) |
| III | Biểu hiện tại các vùng hạch ở cả hai phía cơ hoành – Cộng thêm 1 ổ khu trú tại một cơ quan hay 1 vị trí ngoài hệ bạch huyết LÂN CẬN với một trong các vùng hạch trên (IIIE) – Cộng thêm tổn thương tại Lách (IIIS) – Có thêm cả hai yếu tố trên (III E+S) |
| IV | Lan tràn tại nhiều cơ quan hay vị trí ngoài hệ bạch huyết hoặc biểu hiện đa ổ tại một cơ quan, +/- tổn thương tại hạch HOẶC: Tổn thương khu trú tại một cơ quan hay 1 vị trí ngoài hệ bạch huyết kèm theo hạch nằm ngoài phạm vi hạch vùng tương ứng. |
| Các “hậu tố” khác | A: không có sụt cân/sốt/ra mồ hôi trộm B: có sụt cân/sốt/ra mồ hôi trộm X: khối hạch có đường kính lớn nhất trên 10cm hoặc khối trung thất có đường kính lớn hơn 1/3 đường kính lồng ngực. |
| (*) Các vị trí ngoài hệ bạch huyết bao gồm các vị trí không phải hạch bạch huyết, vòng Waldeyer, mảng Peyer thành ruột, lách và tuyến ức. |
2. Các yếu tố tiên lượng:
– Các yếu tố có ý nghĩa tiên lượng quan trọng nhất đối với HL giai đoạn I/II gồm giai đoạn bệnh theo Ann Arbor, khối hạch lớn (tumour bulk), có các triệu chứng B, số lượng vùng hạch tổn thương, tốc độ máu lắng và biểu hiện tại các cơ quan ngoài hệ bạch huyết. Bên cạnh đó, tuổi và tình trạng bệnh kết hợp là hai yếu tố cần được tính đến khi lập kế hoạch điều trị.
– Nhiều nhóm nghiên cứu kết hợp các yếu tố trên theo những cách khác nhau để xếp loại bệnh nhân thành các nhóm có tiên lượng “thuận lợi” hay “bất lợi” hay “trung gian” nhằm giúp bác sỹ thực hành quyết định chiến lược và phương pháp điều trị. Đối với HL giai đoạn I/II, hệ thống phân nhóm tiên lượng được sử dụng rộng rãi nhất được xây dựng bởi nhóm nghiên cứu Hodgkin của Đức (German Hodgkin Study Group – GHSH) gồm:
+ Nhóm tiên lượng “thuận lợi: không có các yếu tố như khối trung thất lớn, tốc độ máu lắng trên 50 (không kèm theo triệu chứng B) hoặc trên 30 (nếu kèm theo triệu chứng B), có tổn thương ngoài hạch, biểu hiện tại nhiều hơn 2 vùng hạch.
+ Nhóm tiên lượng “bất lợi”: có một trong các yếu tố trên.
– Ngoài ra, điểm số tiên lượng quốc tế (International Pronostic score –IPS) đã được xây dựng và kiểm chứng dành cho giai đoạn tiến triển, dựa trên 7 yếu tố:
+ Giới tính Nam
+ Tuổi trên 45
+ Giai đoạn IV theo Ann Arbor
+ Huyết sắc tố < 105g/L
+ Albumin huyết thanh < 40g/L
+ Số lượng bạch cầu máu ngoại vi trên 15 G/L
+ Số lượng bạch cầu lympho trong máu ngoại vi < 0,6 G/L (hoặc tỷ lệ bạch cầu lympho <8%).
Bệnh nhân được phân tầng nguy cơ dựa trên sự hiện diện hay không của mỗi yếu tố trên. Tiên lượng “bất lợi” nếu có từ 3 yếu tố trở lên. Tỷ lệ sống thêm không tiến triển (PFS) 5 năm tương ứng: 84% (có 0 yếu tố), 77% (1 yếu tố), 67% (2 yếu tố), 60% (3 yếu tố), 51% (4 yếu tố), 42% (trên 5 yếu tố).
– Những bằng chứng gần đây cho thấy PET-CT tại thời điểm sau từ 1 đến 3 chu kỳ hoá trị cho phép đánh giá sớm đáp ứng về mặt chuyển hoá, điều này có giá trị về mặt tiên lượng. Do đó, PET-CT bắt đầu được thử nghiệm đưa vào trong các hệ thống phân nhóm tiên lượng trong u lympho.
III. Nguyên tắc điều trị u lympho Hodgkin
| Chiến lược điều trị u lympho Hodgkin | |
| Giai đoạn I/II HL thể nốt trội lympho bào | – Xạ trị: xạ trị tại vùng hạch bệnh lý (ISRT – Involved site radiation) đơn thuần, tổng liều 30-35 Gy với phân liều 1,75-2 Gy. – Lựa chọn thay thế: phối hợp đa mô thức như HL kinh điển giai đoạn I/II |
| Giai đoạn I/II HL kinh điển (tiên lượng “thuận lợi” | – Đa mô thức: hoá trị ABVD x 2 chu kỳ dẫn đầu trước xạ trị tại vùng hạch bệnh lý (ISRT) với tổng liều 20 Gy. – Lựa chọn thay thế: hoá trị đơn thuần ABVD x 4-6 chu kỳ, với những trường hợp lo ngại tác dụng phụ muộn của xạ trị. |
| Giai đoạn I/II HL kinh điển (tiên lượng “bất lợi”) | – Đa mô thức: hoá trị ABVD x 4 chu kỳ dẫn đầu trước xạ trị (ISRT) với tổng liều 30 Gy. – Lựa chọn thay thế: hoá trị đơn thuần ABVD x 4-6 chu kỳ. |
| Giai đoạn III/IV | – Hoá trị +/- xạ trị củng cố (tuỳ theo đáp ứng) – Lựa chọn khác: hoá trị liều cao (Ví dụ: BEACOPP tăng liều x 6-8 chu kỳ) |
| Theo dõi sau điều trị | – Sau điều trị triệt căn, cắt lớp vi tính hoặc PET-CT để đánh giá đáp ứng sau 6-8 tuần. – Theo dõi tác dụng phụ của điều trị có thể xuất hiện muộn: huyết học, tim, tuyến giáp) – Theo dõi tầm soát ung thư thứ 2 có thể xuất hiện. |
| HL kháng với điều trị ban đầu và HL tái phát | – Vẫn có thể điều trị với mục tiêu triệt căn cho hầu hết trường hợp. – Hoá trị với một số phác đồ như GDP, DHAP, ICE, trước khi ghép tế bào gốc tạo máu tự thân, cân nhắc có/không xạ trị củng cố) – Tỷ lệ sống thêm không bệnh 5 năm có thể kỳ vọng đến 40-60% với những bệnh nhân được ghép tế bào gốc. – Điều trị với mục tiêu triệu chứng cho những trường hợp không dự kiến ghép tế bào gốc. |
Biên soạn dựa trên các tài liệu tham khảo: Sổ tay Huyết học Bethesda, Cẩm nang Ung thư học lâm sàng UICC 9th, NCCN.

